癌症早期精准诊断和高效治疗在临床上仍然是重大难题。常用的分子影像学技术包括X射线计算机断层扫描(CT)、超声(US)、单光子发射计算机断层扫描(SPECT)、正电子发射计算机断层扫描(PET)、磁共振(MR)和荧光成像等,均已被用于肿瘤的诊断。其中,磁共振成像空间分辨率高、断层成像能力强、没有穿透深度限制,是临床中最常用的无创诊断技术之一。荧光成像也显示出高灵敏度和空间分辨率的优势。然而,每种成像模式都有一定的局限性和缺点,因此往往不能独立提供准确的诊断信息。因此,通常需要结合两种或多种成像模式来提高成像的准确性。常规的治疗手段存在多种缺点,手术的不完全切除以及与化疗相关的严重毒副作用和耐药性无法为癌症提供高质量的治疗。因此,发展更加有效的癌症治疗手段在临床上具有重大意义。
生物与医学工程学院李静超团队长期从事纳米平台的开发和肿瘤诊疗一体化方面的研究。针对骨转移部位肿瘤生长和破骨细胞介导的骨溶解形成的恶性循环,团队近期开发了一种双靶向仿生纳米复合体用于骨转移瘤的增强诊疗。这种纳米复合体由表面癌细胞和破骨细胞形成的杂化细胞膜以及内部氧化铁纳米颗粒和半导体聚合物组成。在血液循环中,这种纳米复合物能够在膜蛋白介导的同源靶向作用下有效富集在转移瘤部位。在肿瘤微环境和超声辐照下,半导体聚合物和氧化铁纳米颗粒不仅能够介导磁共振和荧光双模式成像,实现对破骨细胞和癌细胞的检测,还能够介导声动力和化学动力的联合治疗,同时杀伤癌细胞和破骨细胞,抑制肿瘤生长、缓解骨溶解。该纳米复合物具有显著优势包括:利用杂化细胞膜的包覆可以延长纳米复合物的血液循环时间,并实现对破骨细胞和癌细胞的同时靶向作用,提高纳米复合物在肿瘤部位的富集;利用纳米复合物的磁共振和荧光双模式成像同时检测破骨细胞和癌细胞,实现骨转移瘤的早期精准诊断;并利用声动力治疗和化学动力学治疗的联合效应,同时杀死肿瘤细胞和抑制破骨细胞对肿瘤细胞的促生长作用,打破骨转移瘤部位破骨细胞和肿瘤细胞之间的“恶性循环”,提高肿瘤治疗效果。该研究成果发表在《应用化学》(Angewandte Chemie),我校为第一通讯单位,生物与医学工程学院李静超研究员为通讯作者,硕士研究生张伊婧为本文第一作者。
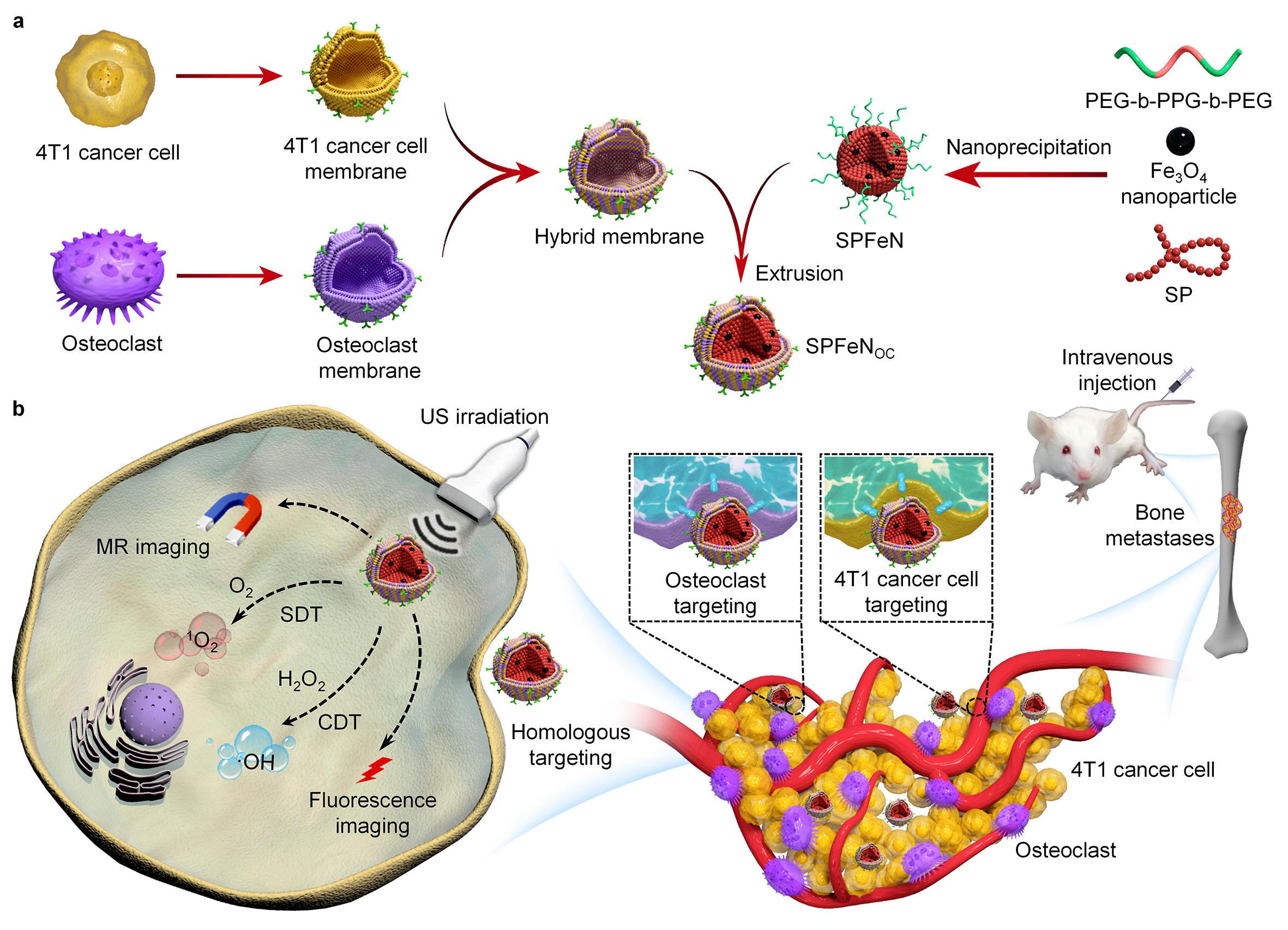
综上,该纳米药物可以在表面杂化细胞膜的介导下实现在肿瘤部位特异性递送药物,与传统的和肿瘤微环境可激活的药物递送纳米系统相比,能够实现更精确的药物递送和联合治疗效果。面向未来,随着各种新兴的仿生纳米技术的开发和成熟,细胞膜仿生修饰的纳米颗粒有望成为肿瘤治疗的重要手段,将对人类肿瘤治疗产生更多积极影响。
该研究工作得到国家自然科学基金、上海市科委、上海市高等学校特聘教授(东方学者)、中央高校基本科研业务基金,以及我校亿万先生mr01官网、人才办等项目和机构的大力支持。
据了解,生物与医学工程学院主动聚焦和服务于国家科技自立自强,积极支持生物学与生物医学工程学科开展交叉合作研究,积极推进“医工交叉”合作研究,以高水平科学研究助力学院事业高质量发展,为学校高水平研究型大学建设贡献力量。