针对癌症早期精准诊断和高效治疗面临的重大难题,生物与医学工程学院李静超特聘研究员团队潜心科研,开发了一系列可激活型纳米药物递送体系用于癌症精准诊疗,取得了具有特色和创新性的研究成果。
免疫疗法逐渐成为癌症治疗的一种主流方式,但单一的免疫治疗如免疫检查点阻断疗法仅受益于一部分患者,主要是由于肿瘤低免疫原性和免疫抑制微环境。目前,免疫治疗主要依赖于全身性注射免疫药物(如单克隆抗体),但这种方式会通过诱导激活自身抗原反应性T细胞引起“脱靶”副作用。针对上述问题,团队开发了近红外光和超声激活型纳米药物递送体系实现不同肿瘤精准免疫治疗效应。通过将免疫药物(NLG919)和自噬抑制剂氯喹(CQ)装载到响应型共轭聚合物纳米载体。此外,团队还构建了一种近红外光激活型共轭聚合物纳米复合物。该纳米复合物在近红外光照射下产生单线态氧,用于光动力治疗以及NLG919和CQ的特异性释放,并通过抑制色氨酸代谢和自噬,增强抗肿瘤免疫反应,从而实现肿瘤的有效治疗(Nano Today,2022,46,101600)。同时团队还报道了一种近红外二区(NIR-II)光激活型半导体聚合物纳米介质(SPNaiB),通过三合一的肿瘤微环境调控策略实现联合免疫治疗(Nano Today,2023,50,101833)。
近年来,结合声动力疗法(SDT)和免疫疗法的声免疫疗法为治疗肿瘤提供了一种新的治疗策略。除了直接清除实体瘤,SDT还会诱导肿瘤细胞免疫原性细胞死亡(ICD),产生特异性的抗肿瘤免疫效应。团队发展了一种基于有机半导体聚合物的纳米双药体系(SPNTi),该双药体系是由活性氧响应型的载体PS-TK-PEG封装有机半导体聚合物,乏氧响应型前药TPZ-conjugate以及MDSCs靶向药物ibrutinib构建而成。该体系在癌症治疗中具有显著优势:一是这种纳米药物可以有效地聚集在肿瘤部位,在超声治疗下产生1O2和消耗氧气,从而实现SDT效应。SDT过程中产生的1O2不仅诱导ICD触发抗肿瘤免疫反应,而且破坏1O2可切割的PS-TK-PEG和纳米粒子的完整性,从而使TPZ-conjugate和ibrutinib能够原位特异性递送到肿瘤区域。二是由于SDT引起的氧气消耗,肿瘤微环境的乏氧加剧,导致TPZ-conjugate的激活,从而诱导ICD效应的增强,释放的ibrutinib可以减轻乏氧诱导的MDSCs募集,从而增强免疫细胞的杀伤肿瘤特性。三是通过SPNTi介导的增强型免疫效应有效地抑制了荷瘤小鼠模型中双侧肿瘤生长并抑制肿瘤转移(Advanced Materials,2023,35,2302508)。硕士研究生丁梦斌为本文第一作者。
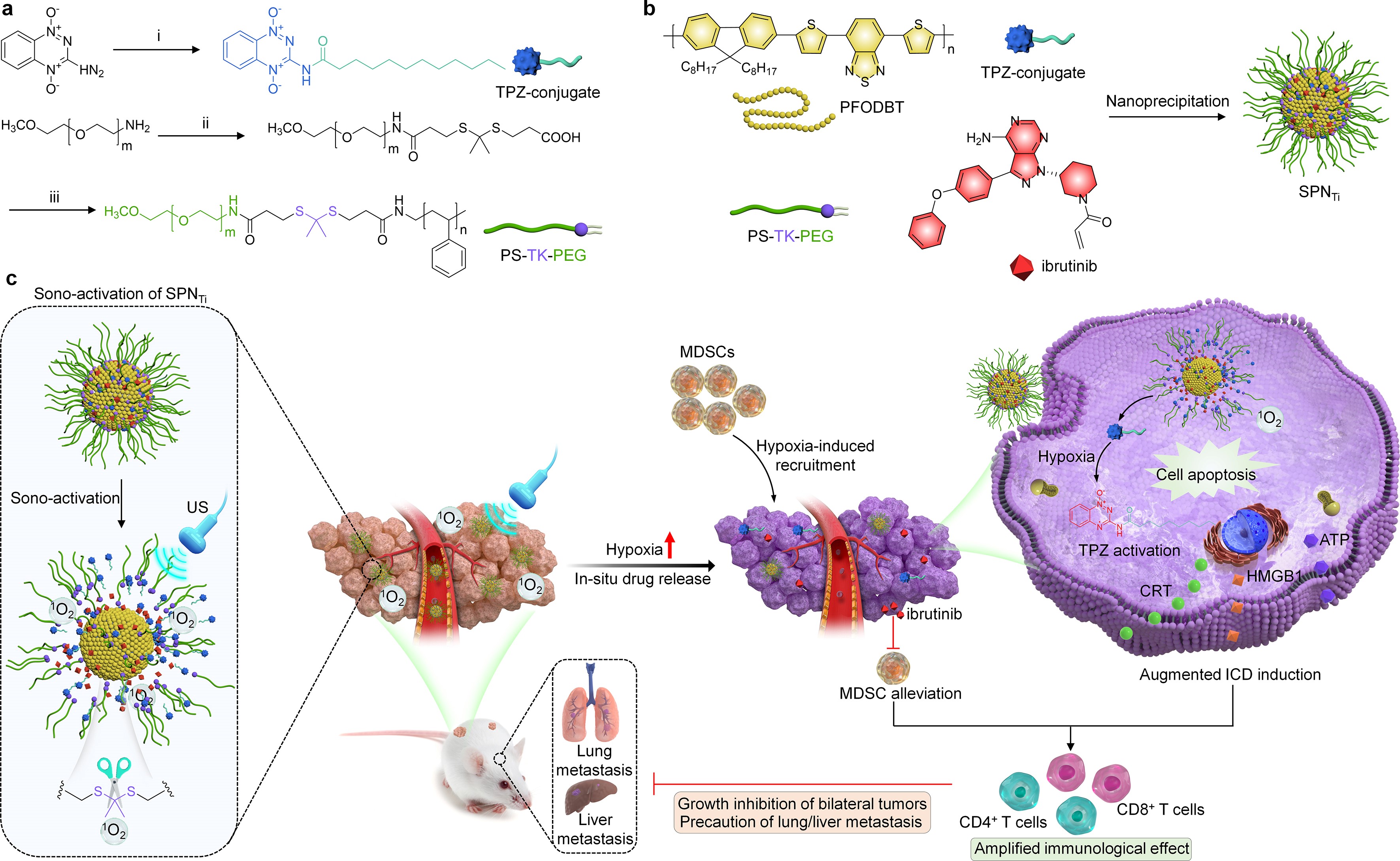
综上,该纳米药物可以在US介导下实现在肿瘤部位特异性递送药物,与传统的和肿瘤微环境可激活的药物递送纳米系统相比,能够实现更精确的药物递送和免疫治疗效应。考虑到超声具有令人满意的组织穿透深度,这种超声激活的免疫治疗策略有望适用于其他深层原位肿瘤模型的治疗。此外团队还与新加坡南洋理工大学浦侃裔教授和上海工程技术大学罗宇副教授合作开发了一种利用超声介导的可激活药理作用构建半导体聚合物促进型纳米调节剂(SPpM)的策略。研究利用SPpM优异的声动力学特性,在肿瘤中原位释放免疫调节剂,通过协同作用逆转两种肿瘤免疫抑制途径来增强抗肿瘤免疫反应,研究成果可用于原位胰腺癌症的深层组织声免疫治疗(Angewandte Chemie,2023,62,e202305200)。该团队近期开发了一种声激活型半导体聚合物纳米反馈剂,通过对上调的免疫抑制通路进行双重调控用于肿瘤免疫治疗(Nano Today,2023,52,101944)。此外,李静超研究员设计了一种超声可激活型半导体聚合物纳米诱导剂,通过声-铁死亡放大氧化损伤协同治疗骨转移瘤(Nano Letters,2023,https://doi.org/10.1021/acs.nanolett.3c02414)。
以上系列研究工作得到了国家自然科学基金委、上海市科委、上海市高校特聘教授(东方学者)和中央高校基本科研业务基金,以及我校亿万先生mr01官网、人才办等项目和机构的大力支持。近期,相关系列成果分别发表在《应用化学》(Angewandte Chemie)、《先进材料》(Advanced Materials)、《纳米快报》(NANO Letters)以及《今日纳米》(NANO Today)等国际知名期刊上。
据了解,生物与医学工程学院主动聚焦和服务于国家科技自立自强,积极支持基础生物学与生物医学工程学科开展交叉合作研究,积极推进“医工交叉”合作研究,推出师资培育“启航计划”,以高水平科学研究助力学院事业高质量发展、为学校高水平研究型大学建设贡献力量。
撰写:生物与医学工程学院